药品抽检是上市后监管的重要手段,在打击违法违规、评价药品质量状况、保障公众用药安全等方面发挥着重要作用。2020年,国家药监局坚持以“四个最严”为根本指南,组织各省级药品管理部门与相关检验机构,在全国范围内对部分药品质量开展抽查检验工作,并深化成果应用,不断加强抽检管理与顶层设计,完善制度体系、整合资源形成监管合力,服务监管的效能进一步显现。2020年抽检结果显示,我国当前药品质量仍处于较高水平,安全形势总体平稳可控。
一、概述
为贯彻落实《中华人民共和国药品管理法》和《中华人民共和国疫苗管理法》,2020年,国家药监局根据《药品质量抽查检验管理办法》等有关要求,以品种为主线,坚持问题导向和风险控制原则,密切结合监管需要,制定年度抽检计划和实施方案。国家药品抽检采取“分散抽样、集中检验、探索研究、综合评价”的工作模式,按照国家药监局的统一部署,各省级药品监管部门负责组织各行政区域内的样品抽取,并将同一品种的全部样品交由同一药品检验机构集中检验;检验机构确认收到样品后,采用“非现场结算”方式统一支付购样费用,并将检验结果以“电子检验报告书”的形式在线传递至有关省级药品监管部门。在法定标准检验的基础上,各检验机构紧盯突出问题、结合监管需求开展有针对性的探索性研究,对抽检品种进行“综合体检”,及时发现、防控风险隐患,督促企业落实质量安全主体责任。
2020年国家药品抽检共完成136个品种18013批次制剂产品与中药饮片的抽检任务,样品来源涉及3586家药品生产、经营企业和使用单位,覆盖境内31个省区市和新疆生产建设兵团,由47家药品检验机构承担检验和探索性研究任务。对检出的104批次不符合规定产品,国家药监局均依照“风险控制-依法处置-排查原因并整改-信息公开”的监管模式,确保风险关闭、警示用药安全。一方面,迅速组织各级药品监管部门及时监督相关企业或单位采取召回、暂停生产销售等有效风险控制措施,对涉事企业或单位依法进行调查处理,深入排查原因、彻底消除隐患;另一方面,以通告的形式,依法及时向公众发布不符合规定产品信息,筑牢公众用药安全防线,全年共发布药品质量通告6期。针对探索性研究发现的问题线索,国家药监局综合研判,依照风险等级及时采取控制措施,对个别涉嫌违法违规生产的企业,组织开展针对性检查;对其他一般性问题,采取风险提示等措施督促相关企业排查整改。
二、抽检数据分析
2020年国家药品抽检共抽取制剂产品与中药饮片品种136个,包括化学药品77个、中成药48个、中药饮片8个和生物制品3个,其中国家基本药物品种45个;共抽检样品18013批次,包括生产环节4106批次、经营环节13143批次和使用环节764批次(见图1),涉及1053家药品生产企业、2186家药品经营企业和347家药品使用单位,各省(区、市)样品抽取情况以及所抽取样品的标示生产企业所在地区抽样分布情况,分别见图2(略)与图3。
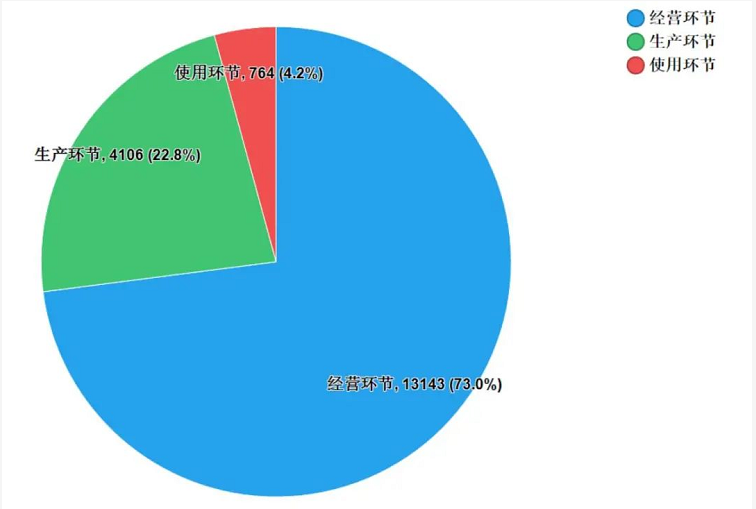
2020年国家药品抽检共抽检制剂产品16645批次。经检验,16568批次产品符合规定,77批次产品不符合规定,其中有2批次样品按照补充检验方法检验检出金胺O。抽检的128个品种中,全部样品符合规定的制剂产品有106个,共13179批次。其中,化学药品有64个品种8046批次,中成药有39个品种5043批次,生物制品有3个品种90批次。
1. 化学药品
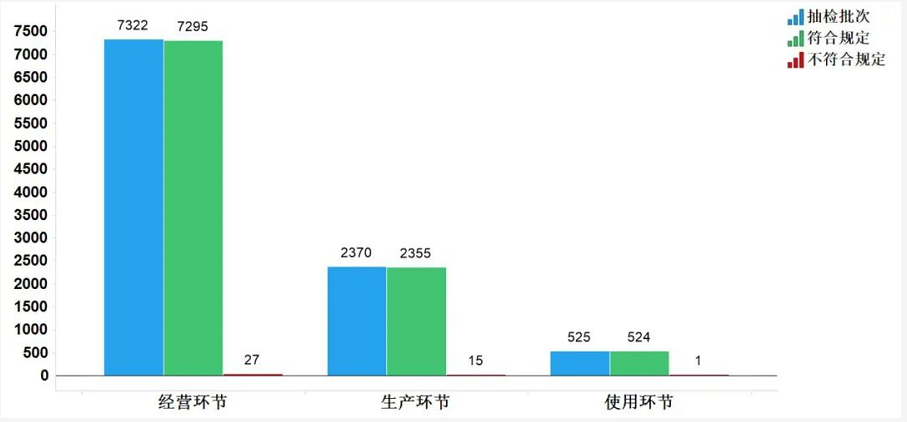
2020年国家药品抽检共抽检化学药品77个品种10217批次,涉及生产环节2370批次、经营环节7322批次和使用环节525批次。经检验,不符合规定43批次,在生产、经营和使用环节检出不符合规定产品15、27和1批次,分别占对应环节全部样品的0.6%、0.4%和0.2%(见图4)。
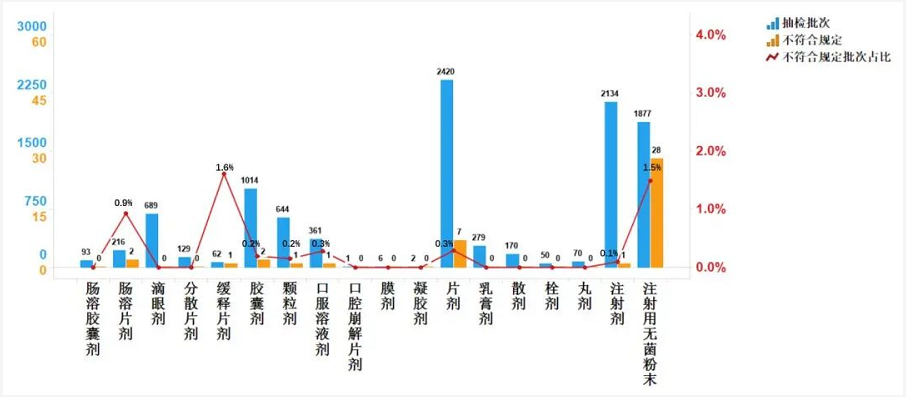
2020年国家药品抽检共涉及18个剂型,共有8个剂型存在不符合规定产品。其中,注射用无菌粉末(28批次)、片剂(7批次)、胶囊剂(2批次)、肠溶片剂(2批次)、颗粒剂(1批次)、注射剂(1批次)、口服溶液剂(1批次)、缓释片剂(1批次),分别占对应剂型全部产品的1.5%、0.3%、0.2%、0.9%、0.2%、0.1%、0.4%和1.6%(见图5)。
不符合规定项目包括性状、检查和含量测定,不符合规定产品数量依次为1、42和1批次,分别占全部不符合规定项目的2.3%、95.4%和2.3%(见图6)。
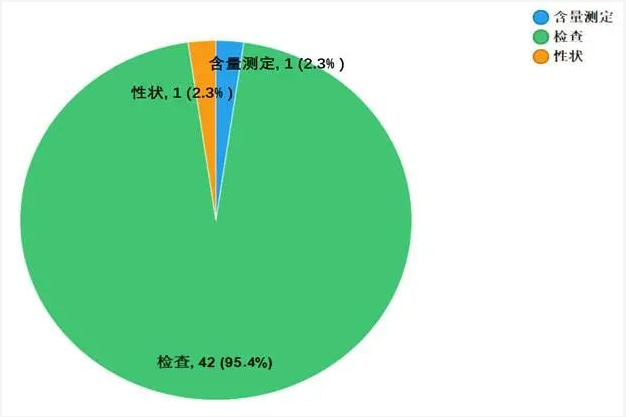
抽检数据显示,生产环节与经营环节出现不符合规定情况高于使用环节,且注射用无菌粉末在上述两个环节占比较大,分别检出不符合规定产品13批次与15批次,占对应环节不符合规定样品的86.7%和55.6%;不符合规定项目均为检查项,涉及“溶液的澄清度与颜色”“可见异物”“有关物质”等检验项目,不符合规定原因主要与生产工艺不稳定、包装材料质量控制不严、贮藏条件选取不当存在关联。提示生产企业应严格包装材料入厂检验,优化生产工艺管理与关键质量参数控制,重点关注分装与灭菌工艺的稳定性;经营企业应完善药品储存、运输过程管理,提升温湿度控制水平,重点关注需遮光、冷藏贮存的药品。
2. 中成药
2020年国家药品抽检共抽检中成药48个品种6338批次,涉及12个剂型,在生产、经营和使用环节各抽取样品1072、5197、69批次。经检验,符合规定6304批次,不符合规定34批次(含2批次产品经补充检验方法判定不符合规定),分别在生产与经营环节检出不符合规定产品1和33批次,分别占对应环节全部样品的0.1%和0.6%(见图7)。
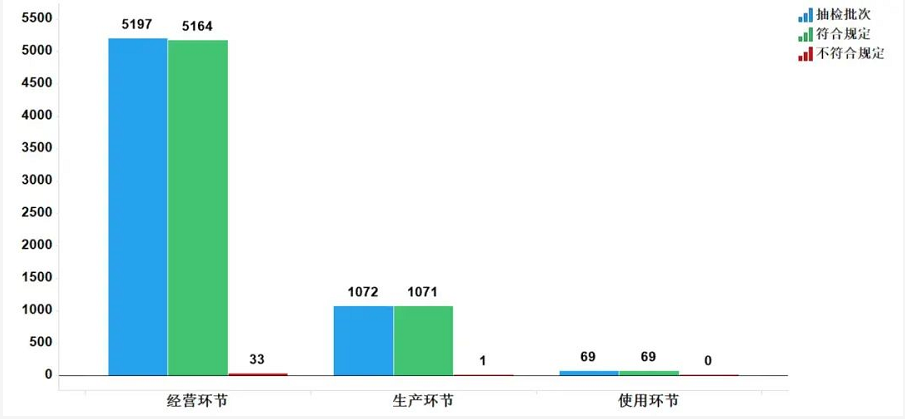
不符合规定项目主要涉及检查、性状、鉴别、含量测定等,不符合规定产品数量依次为14、2、15和2批次,分别占全部不符合规定项目的40.0%、5.7%、42.9%和5.7%(见图8)。
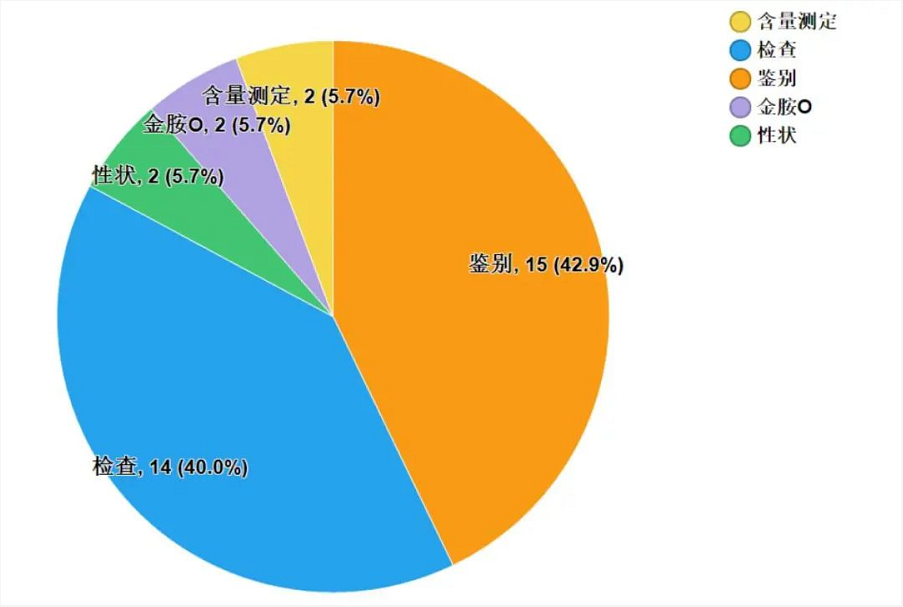
不符合规定产品主要涉及5个剂型,其中丸剂(16批次)、颗粒剂(7批次)、片剂(5批次)、散剂(5批次)和注射剂(1批次),分别占对应剂型全部样品的2.0%、0.5%、0.4%、2.7%、0.1%(见图9)。
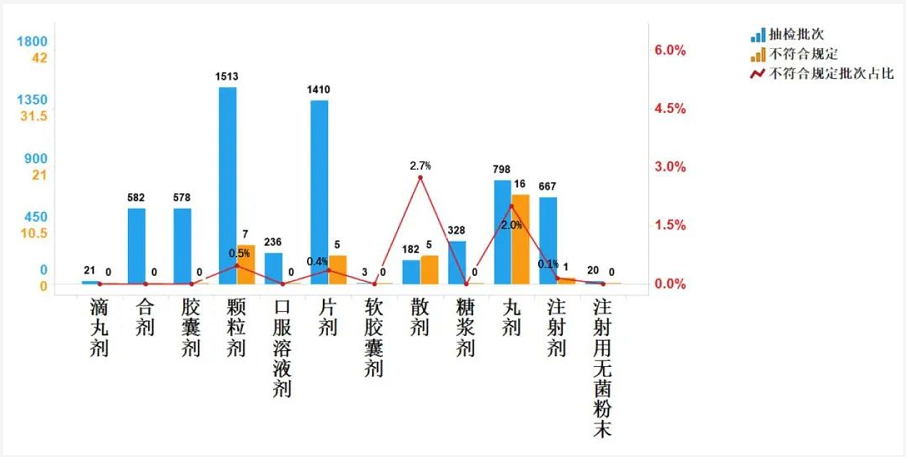
抽检数据显示,丸剂与散剂不符合规定批次占比较高,不符合规定项目包括鉴别与检查,不符合规定原因主要与药材掺伪、制剂工艺控制不严等存在关联,提示有关企业应加强人员培训,规范生产管理,严格工艺规程与购进药材质量控制。
3. 生物制品
2020年国家药品抽检共抽检生物制品3个品种90批次,其中治疗类品种1个,预防类品种2个(见图10)。样品均抽自生产环节,剂型均为注射剂。经检验,所检项目均符合规定,合格率为100%。
4. 国家基本药物
2020年国家药品抽检共抽检基本药物(不含中药饮片)37个品种6167批次,在生产、经营和使用环节各抽取样品1260、4625和282批次。经检验,不符合规定25批次,分别在生产与经营环节检出不符合规定产品8和17批次,涉及4个剂型。
5. 抗病毒中成药专项
2020年国家药品抽检设置了抗病毒中成药专项,以有效识别风险、保障临床常用关键抗病毒中成药的质量。
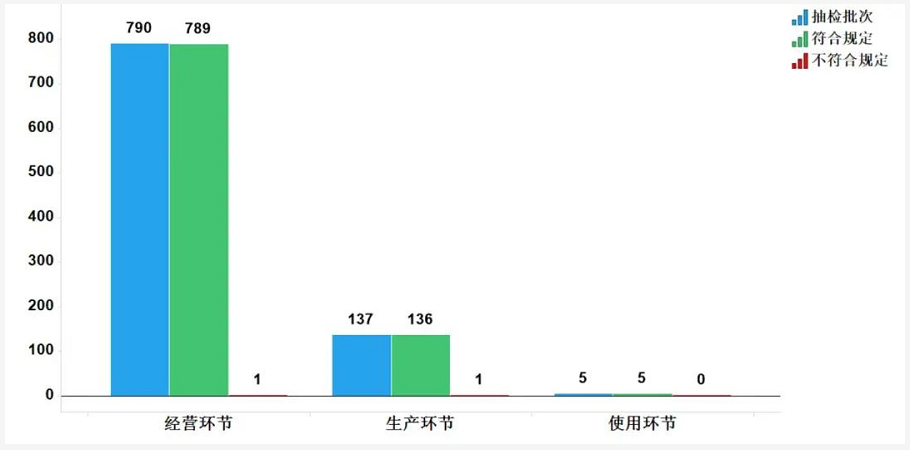
2020年共抽检抗病毒中成药932批次,涉及5个剂型(图13)。经检验,符合规定930批次,合格率99.8%。在生产、经营和使用环节各抽取样品137、790和5批次,分别在生产与经营环节检出不符合规定产品1批次(图14)。
(三)中药饮片专项抽检情况
2020年,国家药监局组织开展了中药饮片专项抽检。主要针对近年来销量增大的中药饮片中较为突出的掺伪掺杂等问题,以及种植/养殖、加工炮制等不规范而造成的质量问题,开展检验和探索性研究。
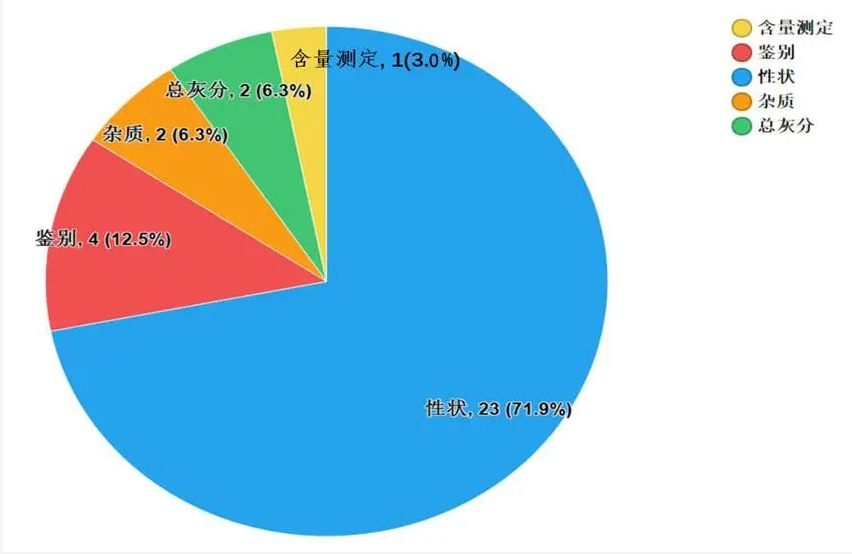
2020年国家药品抽检共抽检8个中药饮片品种1368批次。经检验,符合规定1341批次,不符合规定27批次(见图15)。不符合规定项目主要涉及总灰分(2批次)、性状(23批次)、杂质(2批次)、鉴别(4批次)和含量测定(1批次)等方面,分别占全部不符合规定项目的6.3%、71.9%、6.3%、12.5%和3.0%(见图16)。
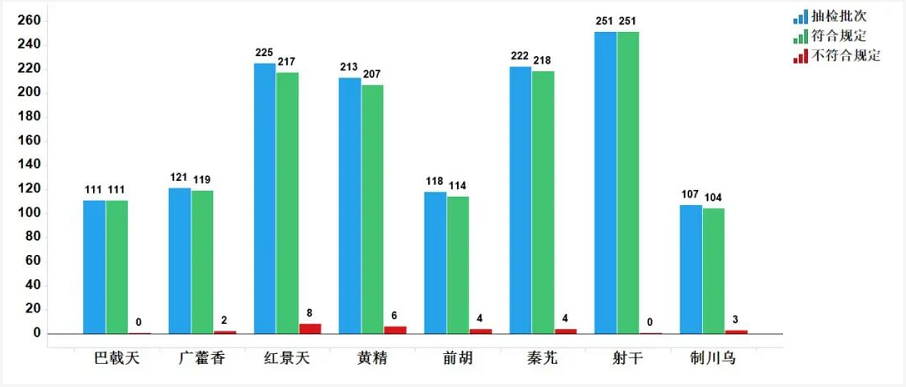
2020年国家药品抽检发现的主要问题有:一是掺伪、正伪品混用问题,如制川乌中混入部分附子;二是有害残留物质超限问题,如部分批次前胡农药残留超限;三是采收与加工炮制不规范,如广藿香未按标准方法采收,部分批次黄精加工炮制不规范造成总灰分超标。抽检结果提示,有关企业应规范采收加工及炮制工艺,加强进厂或投料前检验,严格储运条件,控制环境湿度,提高质量意识。
(四)探索性研究
2020年国家药品抽检探索性研究发现的主要问题有:一是违法违规生产,个别企业低限、过量或使用替代品投料,违反关键制法,质量保障体系缺失以致生产线污染等问题依然存在;二是生产工艺设置不合理或控制系统缺失,导致同一品种质量存在差异;三是部分品种防腐剂、重金属、农药残留超限;四是原药材与辅料质量控制不严,部分企业使用掺伪、染色的原药材和劣质辅料用于成方制剂生产;五是包装材料相容性不好影响产品稳定性。
三、抽检结果应用
药品抽检是药品监督管理部门根据监管需要,依法对生产、经营和使用的药品及其责任主体所采取的抽查检验行为,其根本目的是识别防控风险、消除安全隐患。2020年,药品监管部门充分利用国家药品抽检结果,严厉打击制售假劣药行为,不断推动监管机制创新和抽检数据深度利用,完善药品抽检管理体系,提高风险防控能力。
一是严格核查处置。2020年,国家药品抽检的靶向性进一步提升,基于往年抽检数据,加大流通环节抽检力度,保障经营与使用单位药品质量;同时,遴选临床用量较大、使用范围较广的抗病毒中成药设置专项抽检,全年共抽检抗病毒中成药品932批次,排查潜在隐患,有效降低了区域性、系统性风险。针对104批次不符合规定的产品,国家药监局牢固树立风险意识,第一时间采取查封查扣、暂停销售等控制措施,并组织各省级药品管理部门对涉事企业或单位进行调查处理,有力震慑不法企业,净化市场环境。
二是形成监管合力。为提高药品抽检工作服务监管的效能,2020年,国家药监局不断推动抽检数据深度利用,将抽检结果与检查、稽查执法等工作有机衔接,形成监管合力。例如,探索性研究发现部分批次复方甘草酸铵注射液抗氧剂超限,经检查发现个别企业涉嫌擅自违规过量投料;检验中发现,部分批次元胡止痛片存在金胺O,经检查发现个别企业质量控制不严,使用劣质药材投料。不断提升的检验研究水平与高效协同的质量监管体系,有效遏制个别企业的侥幸心理,提高了企业的质量安全意识。
三是完善制度体系。新修订的《中华人民共和国药品管理法》《药品质量抽查检验管理办法》和《药品抽样原则及程序》对药品抽检工作提出了更高的要求。2020年,国家药监局组织相关单位完善制度管理体系、创新监管方式方法,一方面对原有的通知文件进行优化整合,印发《国家药监局关于进一步加强国家药品抽检管理工作的通知》并配套制定若干工作程序,构建了相互衔接、上下联动的全新管理文件体系,畅通管理制度内循环;另一方面,建立专家分析研判机制,对药品抽检全周期涉及的品种遴选、异议申诉、质量评议等工作进行综合研判,确保各项措施的科学性。目前,药品抽检专家库有来自监管、检验、审核查验、不良反应监测、标准制定等多个领域的专家500 余名。
四是加强信息化建设。为提高智慧监管水平,中检院在国家药监局带领下,进一步完善全国药品抽检信息平台建设,充分整合最新信息技术,实现检验报告书等相关文件的线上传递,确保数据发布与信息传递的统一性和规范性;构建即时推送和风险预警模块,随时跟踪工作任务和自动分析抽检数据。截至目前,国家药品抽检工作已实现从品种遴选到核查处置的全生命周期、实时在线管理。此外,为推动数据转化赋能,平台将积累的海量数据与深度研究报告向各有关单位开放共享,现已纳入抽检信息154 万余条,质量分析报告、年度质量状况报告、专题研究报告等上千册,为审核查验、标准提高等监管决策提供了重要参考。不断提高的信息化建设水平,极大提升了抽检工作运转效能,同时为样品购买等新政策、新要求的顺利实施提供有力的技术支撑。
五是促进高质量发展。对于探索性研究发现的一般性问题,药品监管部门通过“药品质量提示函”等形式反馈相关企业,不断推动企业落实主体责任,督促企业提升质量保障体系。例如,消栓再造丸的探索性研究提示,部分批次产品的挥发性成分含量下降可能与原药材打粉后放置时间过长有关;呋塞米注射液的探索性研究发现,部分企业选取的包装材料可影响药品稳定性。在此基础上,中检院继续在官方网站公开国家药品抽检的探索性研究情况,2020年共发布63个品种的新建检验方法、联系方式等内容,方便相关单位共享利用,围绕发现的药品质量问题和检验检测新技术进行交流,促进行业高质量发展。
六是搭建共治平台。为深化信息公开,促进社会共治,2020年,国家药监局继续以通告的形式,向全社会发布不符合规定产品信息;同时,国家药监局网站开设抽检信息查询平台,向社会公开国家药品抽检结果,并提供相关数据查询,目前已收录不符合规定药品数据1.5万余条。2020年12月,一年一度的“药品质量安全年会”以线上形式举办,年会基于国家药品抽检结果,分析药品质量状况,分享最新检验检测技术,助力企业质量管理水平提升,为药品检验机构与相关企业搭建沟通交流平台,进一步夯实企业主体责任和提升监管效能。
四、结语
2020年,全国药品监管部门认真落实党中央、国务院决策部署和国家药监局有关工作要求,坚持人民至上、保障用药安全有效、助力疫情防控,顺利完成国家药品抽检工作。检验及研究结果显示,我国药品质量仍处于较高水平,整体安全形势平稳可控。
2021年是“十四五”规划的开局之年,也是迎接后疫情时代曙光的关键之年。国家药监局将继续慎终如始抓好疫情防控,扎实做好“六稳”“六保”工作等决策部署,坚持完善药品抽检管理体系,不断创新监管的制度机制和方式方法,认真贯彻落实《中华人民共和国药品管理法》和《中华人民共和国疫苗管理法》,协同高效做好新形势下的药品抽检工作,着力保障药品安全形势稳定。
