前言:当地时间2017年6月19日,美国FDA批准了Melinta公司的新型喹诺酮类抗生素delafloxacin(商品名:Baxdela,包括片剂与注射剂)用于治疗急性细菌性皮肤与皮肤组织感染(ABSSSI)。该药于2012年8月被FDA根据《抗生素研发激励法案》(即《GAIN法案》)认定为“合格感染疾病产品”(即QIDP),也是继Dalbavancin、Tedizolid、Oritavancin、Ceftolozane/他唑巴坦与头孢他啶/Avibactam之后第6个获得FDA批准上市的抗菌药物。《GAIN法案》是由奥巴马政府于2012年签署的旨在鼓励抗生素开发的法案,就国内而言,2016年8月,为加强抗菌药物管理,遏制细菌耐药,维护人民群众健康,促进经济社会协调发展,我国政府发布了《遏制细菌耐药国家行动计划》,从联防联控、药品研发、供应管理、加强监测等方面提出了重点措施和工作目标,并着重强调了鼓励新型抗菌药物的研发,从而为国内抗菌药物的研发提供了政策保障。
本文首先介绍了FDA近几年批准上市的几种QIDP类抗菌药物,而后分析了国内抗菌药物的市场情况,最后对抗菌药物的研发提出了建议和意见。
说明:
本文所引用的注册申报信息与已有厂家数量信息均由药智数据提供;样本医院销售额来自于上海医工院的Pharmarket数据库。
一、获FDA批准的QIDPs
(一)基本信息
1.概况
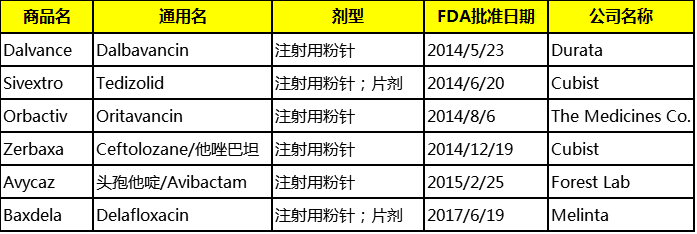
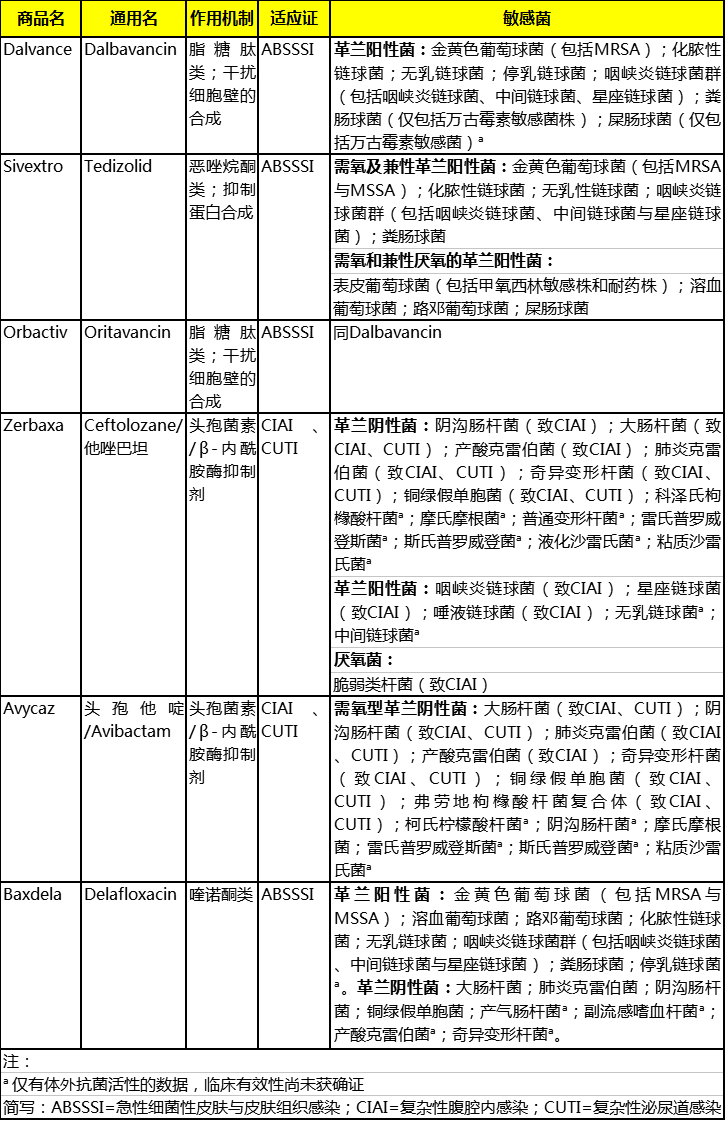
2.药学信息
(二)专利信息
1.基于OrangeBook的专利信息
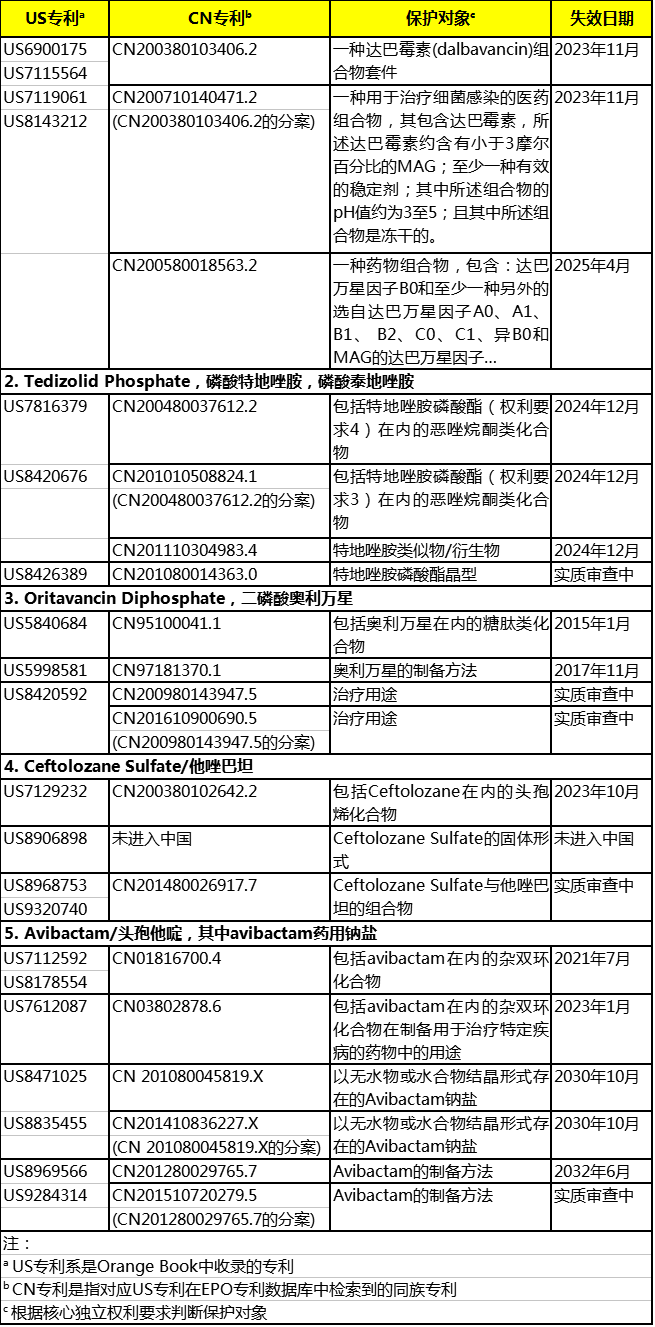
2.其他专利
(1)Dalbavancin的化合物专利
OrangeBook中未收录Dalbavancin的化合物专利。
FDA批准的Dalbavancin药品标签指出,药用的dalbavancin是由5种结构相近的同系物所组成的混合物,结构母核及各取代基的含义如下所示。
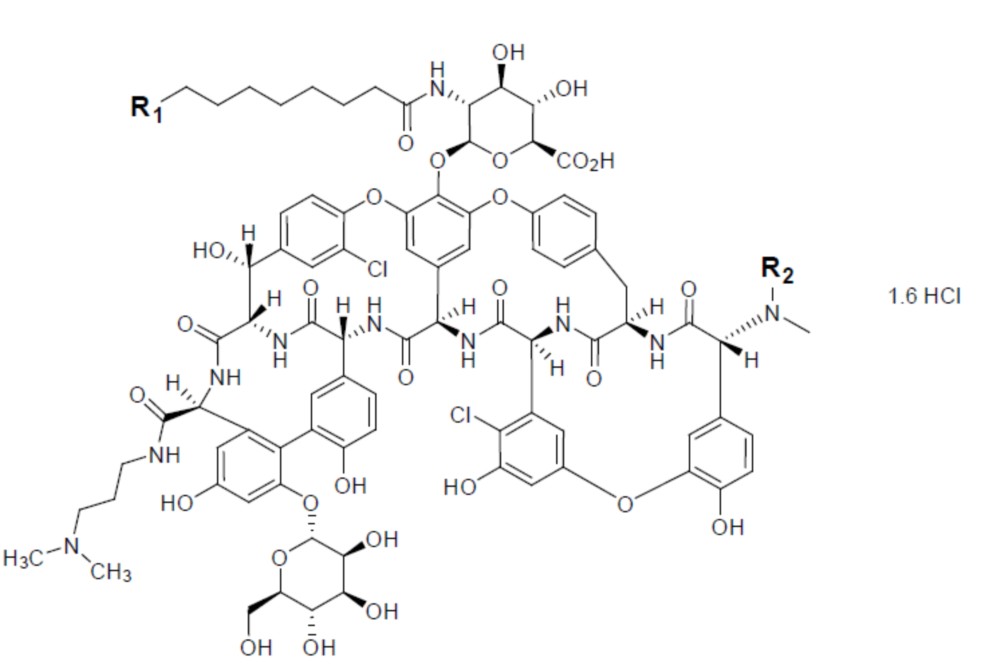
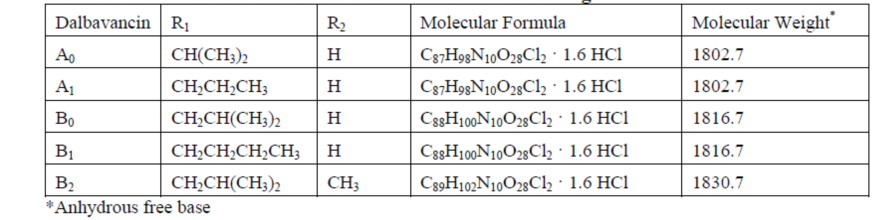
FDA专家委员会对Dalbavancin进行评审时的资料(UCM390793)指出,dalbavancin是A-40,926的半合成衍生物。
根据ThomsonReuters报告的信息,dalbavancin的化合物专利为US5750509,该专利保护了A-40,926,其化合物权利要求覆盖了Dalbavancin的五种同系物。该专利的优先权日期为1991年7月29日,未进入中国。
(2)Delafloxacin的核心专利
Delafloxacin以甲葡胺盐的形式供药用。
中国专利CN96198104.0保护了包括delafloxacin在内的喹诺酮类化合物,该专利已于2016年失效。
CN99123311.5作为CN96198104.0的分案,仅保护了delafloxacin及其相关化合物。
PCT专利WO2006042034披露了Delafloxacin的甲葡胺盐及其晶型,但该专利未进入中国。
由于时间与篇幅的问题,笔者未进一步检索delafloxacin的组合物专利。本品系由WakunagaPharmaceuticalCo.,Ltd原研(化合物专利申请人),后于1999年被转让给了Abbott公司(晶型专利申请人),2006年转让给了Rib-X公司(现在Melinta),读者可根据上述公司结合相关分类号与/或关键词进行进一步检索。
(三)国内注册申报情况
1.盐酸达巴万星原料药与注射用粉针
虽然盐酸达巴万星在美国上市较早,国内申报的数量却远少于特地唑胺。截止2017年6月19日,共检出与之相关的受理号7个,均为CXHL申报(即国产化药新药报临床),涉及杭州中美华东制药有限公司、正大天晴药业集团股份有限公司(与连云港润众制药有限公司联合申报)以及四川制药制剂公司,其中仅有杭州中美华东制药有限公司所申报的原料药与注射用粉针均获准临床。
2.磷酸特地唑胺原料药、注射用粉针与片剂
截止2017年6月19日,磷酸特地唑胺原料药与制剂的国内申报情况如下表所示。
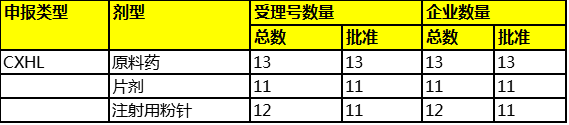
此外,进口方已经启动了进口化药新药的生产申报(JXHS),说明已经完成了临床试验。
3.奥利万星原料药与注射用粉针
目前仅有注射用奥利万星的进口注册申报(JXHL)记录,且于2017年7月获准临床。
4.Ceftolozane Sulfate/他唑巴坦与Avibactam/头孢他啶
此两种药物均暂无国产与进口注册申报记录。
二、国内抗菌药市场情况
2016年样本医院内用药金额排名前10的抗菌药及其用药金额如下表所示。
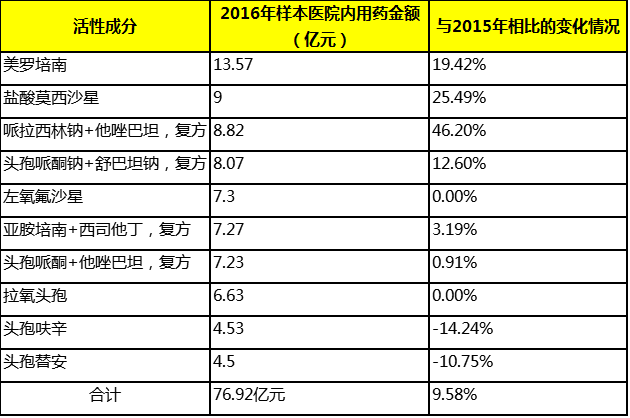
从上表可以看出,除了头孢呋辛与头孢替胺用药金额较2015年有所下降,左氧氟沙星及拉氧头孢与2015年持平以外,其他各种抗菌药的用药金额较2015年均有不同程度的增长,其中,排名前4年美罗培南、莫西沙星、哌拉西林/他唑巴坦复方以及头孢哌酮/舒巴坦复方更是实现了两位数的增长。
三、国内抗菌药研发的挑战与机遇
(一)挑战
1.抗菌药临床应用管理日趋严格(吴秀云.“限抗令”升级,逼退抗生素?[N].医药经济报,2016-04-22(007).)
最严“限抗令”及相关制度的实施让抗生素行业大伤元气。经过几年的休养生息,抗生素类市场规模在低位平稳徘徊。2015年国家出台了一系列关于抗生素合理使用的相关政策:
1月底,卫计委颁布“行动计划”提出“加强合理用药,运用处方负面清单管理、处方点评等形式控制抗菌药物不合理应用。至2017年底前综合医院住院患者抗菌药物使用率不超过
60%,抗菌药物使用强度控制在每百人40DDDs/天以下,其他类别医院需达到抗菌药物临床应用专项整治指标”。8月底发布《抗菌药物临床应用指导原则(2015
版)》,2004年版本同时废除。
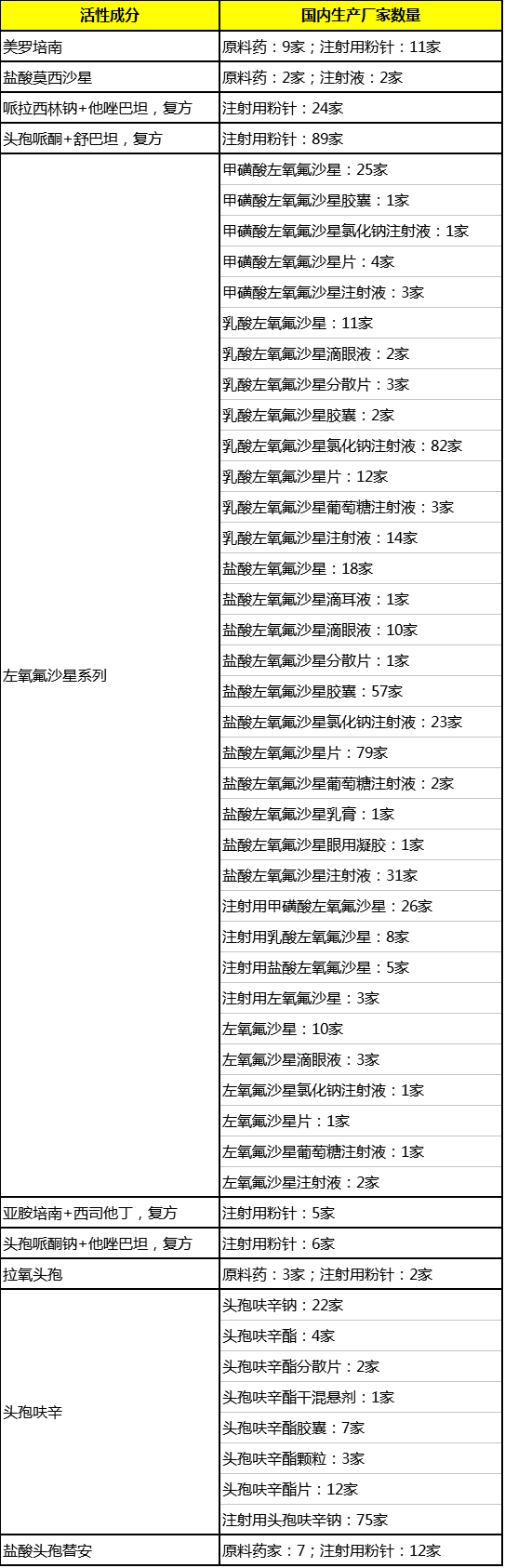
2.重复申报现象严重,创新程度低
根据智数据,前文“2016年样本医院用药金额排名前10的抗菌药”已有国产厂家数量如下表所示。
<, P style="PADDING-BOTTOM: 0px; WIDOWS: 1; TEXT-TRANSFORM: none; BACKGROUND-COLOR: rgb(255,255,255); TEXT-INDENT: 2em; MARGIN: 0px; PADDING-LEFT: 0px; PADDING-RIGHT: 0px; FONT: 14px/25px 'Microsoft Yahei', Tahoma, Helvetica, Arial, 宋体, sans-serif; WHITE-SPACE: normal; LETTER-SPACING: normal; COLOR: rgb(51,51,51); WORD-SPACING: 0px; PADDING-TOP: 0px; -webkit-text-stroke-width: 0px">
(二)机遇-14部委联手支持抗菌药的研发(李瑶.14部委联手支持抗菌药相关研发[N].医药经济报,2016-08-29(001).)
2016年8月25日,国家卫生计生委、发改委、食药监总局等14部门联合制定并印发《遏制细菌耐药国家行动计划(2016-2020年)》(以下简称《行动计划》),从国家层面实施综合治理策略和措施,对抗菌药物的研发、生产、流通、应用、环境保护等各个环节加强监管,加强宣传教育和国际交流合作,应对细菌耐药带来的风险挑战。
《行动计划》提出,到2020年争取研发上市全新抗菌药物1~2个,新型诊断仪器设备和试剂5~10项。零售药店凭处方销售抗菌药物的比例基本达到全覆盖。省(区、市)凭兽医处方销售抗菌药物的比例达到50%。健全医疗机构、动物源抗菌药物应用和细菌耐药监测网络;建设细菌耐药参比实验室和菌种中心;建立医疗、养殖领域的抗菌药物应用和细菌耐药控制评价体系。全国二级以上医院基本建立抗菌药物临床应用管理机制;医疗机构主要耐药菌增长率得到有效控制。人兽共用抗菌药物或易产生交叉耐药性的抗菌药物作为动物促生长应用逐步退出;动物源主要耐药菌增长率得到有效控制。对全国医务人员、养殖一线兽医和养殖业从业人员完成抗菌药物合理应用培训、全面实施中小学抗菌药物合理应用科普教育、开展抗菌药物合理应用宣传周等目标。
鼓励开展细菌耐药分子流行病学和耐药机制研究。及时掌握我国不同地区、人群、医疗机构、动物等细菌耐药发展趋势、传播与差别,加大基础研究力度,阐释细菌致病和耐药机制,为制订耐药控制策略与研究开发新药物新技术提供科学数据;支持新型抗感染药物、仪器设备和疫苗的研发。加强细菌耐药防控科技部署,支持新型抗感染药物研发,特别是具有不同作用机制与分子结构的创新药物研发;支持耐药菌感染快速诊断技术的研发,特别是快速鉴别细菌感染与非细菌感染的技术设备、耐药菌快速检测仪器设备以及基层医疗机构应用微生物检测仪器设备的研发;支持相关疫苗研发。推动动物专用抗菌药物和可替代抗菌药物的动物疾病预防与促生长产品研究与开发;支持耐药菌感染诊断、治疗与控制研究。包括新的治疗方案、优化剂量、耐药菌感染治疗策略以及临床少用抗菌药物的再评价等,提高临床治疗感染性疾病的能力水平;开展抗菌药物环境污染控制研究,进行抗菌药物污染治理技术、抗菌药物在水环境和土壤中的去除以及修复技术等研究。
四、建议与对策
1.建立完善的融资渠道
做好资金准备我国现有的大部分制药企业规模偏小,每年的研发投入水平远远低于跨国医药公司,导致新药研制能力低下。企业应对抗菌新药研发阶段进行细分,针对各阶段不同的风险及资金需求,做好资金使用计划。选择恰当的融资渠道,降低研发创新的资金成本,提高收益。
2.建立以临床需求为导向的整体研发策略
抗菌药的研发是一个循序渐进的过程,从确定用于人体试验的初始剂量到大规模的临床试验,所有的研究都应是系统有序的。建议企业对研发的整体计划及研究步骤进行深入全面的考虑,包括对什么时间开始何种试验项目,获得研究结果后如何支持下一步研究都要有整体的规划。明确界定和准确把握抗菌新药能取得的疗效和可能带来的风险,权衡利弊后考虑是否上市。
3.建立研发合作关系
抗菌药的研发需要多学科相互配合,制药企业应该和科研机构、高校乃至专业的生物技术公司联合进行投资。制药企业作为研发主体,科研机构、高校等承担基础研究,实现优势互补。同时,加强与跨国企业的研发合作,学习国外的先进技术和创新管理方法,为我国抗菌药的研发创新打下良好基础。
上一篇:医疗大数据分析的机会和挑战
