就在这个月初,国家卫健委等五部委联合制定的《第一批罕见病目录》正式发布,121种疾病被收录其中,“渐冻人症”——肌萎缩侧索硬化症也在其列。此前的5月23日,国家药监局、国家卫健委联合公布药审新政,进口罕见病药品可以提交境外取得的临床试验数据,直接申报药品上市注册申请。这无疑将让罕见病药物研发企业享受更多的政策红利,从而激发企业对孤儿药研发的积极性。
每年6月21日是世界渐冻人日,是ALS/MND国际联盟组织,为了唤起世人对肌萎缩侧索硬化症(ALS)这一严重疾病的重视而提出的。大家对“渐冻人”治疗市场了解多少?
运动神经元病作为一种神经系统慢性致死性变性疾病,目前尚无将其治愈的方法。随着神经科学的发展,现阶段治疗研究的发展方向包括神经保护剂、抗兴奋毒性药物、神经营养因子、抗氧化和自由基清除剂、干细胞和基因治疗等方面。
石药集团于2018年3月11日晚间公布,石药集团开发的用于治疗肌萎缩侧索硬化症的药物“消旋-3-正丁基苯酞”(丁苯酞),获得美国食品药品监督管理局(FDA)颁发的孤儿药资格认定。渐冻人临床用药从利鲁唑的孤军作战,发展到丁苯酞、依达拉奉、利鲁唑三足鼎立的局面。
罕见病成医药市场新宠
迄今为止,全球已有近400种孤儿药上市,另有450种药物在研发中。根据前瞻产业研究院发布的《2017-2022年中国生物医药行业市场前瞻与投资战略规划分析报告》统计,2016年美国FDA批准了9个孤儿药,占全部批准新药的41%。2017年美国FDA批准原创新药中有22个孤儿药,同比上一年增长了144%。
据医药市场调研机构Evaluate Pharma的报告,2017年全球孤儿药市场为1240亿美元,较上一年增长8.6%;TOP10孤儿药利妥昔单抗、来那度胺、依库珠单抗、依维莫司、尼洛替尼、硼替佐米、干扰素β1-a、培美曲赛、伊匹木单抗、达沙替尼合计销售额290.66亿美元,预计2018年将达328.98亿美元,增长率达13.18%。
渐冻人症市场青涩
肌萎缩侧索硬化症(ALS)也叫运动神经元疾病,俗称“渐冻人症”。这是一种罕见性疾病,多见于40~50岁的男性,其病因至今不明,医学认为部分病例与遗传及基因缺陷有关。渐冻人症是运动神经细胞进行性退化,导致的四肢、躯干、胸部腹部肌肉逐渐无力和萎缩,以及言语、吞咽和呼吸功能減退,直至呼吸衰竭死亡。
全球渐冻人症发病率很低,但对患者的生活质量及生命构成极大的威胁。中国新药研发监测数据库CPM的数据显示,2016年美国FDA批准孤儿药名单中,因“冰桶挑战赛”而闻名的渐冻人症药物排名第7位,在研的品种33个。
美国FDA现已批准了2个“渐冻人症”治疗药物。第一个是1996年美国FDA批准赛诺菲安万特公司开发的Rilutek;第二个是2017年“全球渐冻人日”前夕,美国FDA日批准了日本田边三菱公司的依达拉奉用于治疗渐冻人症。因此,石药集团丁苯酞获得美国FDA颁发的孤儿药资格认定后,将成为渐冻人症治疗药物的又一个新品种。
丁苯酞剑走偏锋
石药集团开发的丁苯酞软胶囊2005年获得中国药监部门的生产批文,用于治疗轻、中度急性缺血性脑卒中,商品名为恩必普。丁苯酞软胶囊可与复方丹参注射液联合使用,或与低分子肝素、阿司匹林、降纤酶分别合用,可有效的改善急性脑梗死神经功能缺损。2010年在国内城市医院用药市场已突破亿元,尤其是2010年丁苯酞氯化钠注射液上市后有了长足迈进。
丁苯酞是我国第三个拥有自主知识产权的国家一类新药,在全球86个国家受到专利保护,2015年开始已在中国进行了丁苯酞治疗“渐冻人症” 的临床研究。与此同时,石药集团已与美国和韩国两家知名公司,签署了恩必普软胶囊在欧美和韩国市场的专利使用权转让协议。
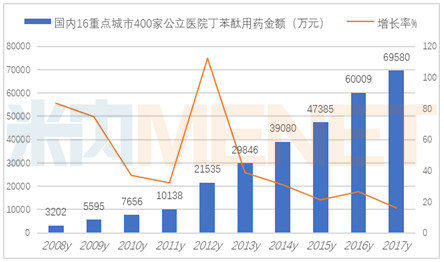
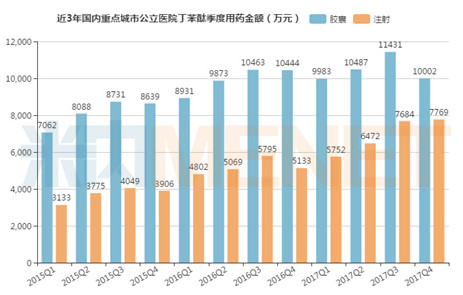
据米内网数据显示,2017年国内16个重点城市400家公立医院丁苯酞的用药金额为6.96亿元,同比上一年增长了15.95%。国家1类新药丁苯酞是石药集团拥有专利保护的独家产品,全球唯一具有线粒体保护作用的脑微循环重构剂,主要用于急性缺血性脑卒中的治疗,有软胶囊及注射剂两种剂型,且两种剂型均已进入新版国家医保目录。
丁苯酞氯化钠注射液是国际上首个作用于急性缺血性脑卒中多个病理环节的创新药物。丁苯酞氯化钠注射液相对于软胶囊更适合于急性缺血性脑卒中患者早期使用,对于急性缺血性脑卒中患者,可以不受溶栓治疗窗的限制,可改善缺血区脑灌注,改善神经功能缺损程度,挽救半暗带脑细胞。据米内网数据,2016年在中国公立医疗机构终端及中国城市零售药店终端丁苯酞合计销售额为29.26亿元,预测2017年丁苯酞终端市场在35亿左右,增长率超过20%。
丁苯酞获得美国FDA的孤儿药资格认定后,在美国可享有7年市场独占权,以及最多高达50%研发费的税务减免,极大地拓宽了学术交流及市场空间。
依达拉奉的新机遇
依达拉奉是一种脑保护剂(自由基清除剂)。临床上多用于阻止脑梗塞的进展,缓解其伴随的神经症状,抑制迟发性神经元死亡和脂质过氧化,清除自由基,从而抑制脑细胞、血管内皮细胞、神经细胞的氧化损伤。
依达拉奉是2001年日本三菱制药公司研制上市的新药。2003年美国《缺血性脑卒中患者的早期处理指南》和2004年日本的《脑卒中治疗指导原则》确认依达拉奉是唯一经大规模临床试验证实有效的的神经保护剂。
2017年5月5日,美国FDA批准了田边三菱的依达拉奉用于治疗肌萎缩侧索硬化症,即渐冻人症,是22年来首个批准的肌萎缩侧索硬化(ALS)的新药,用药后可以延缓渐冻人身体机能下降。
数据显示,2010年全球日本三菱的依达拉奉市场达到顶峰的3.52亿美元,随后几年的销售额一直为1亿多美元。美国FDA批准用于渐冻人治疗后,将提升依达拉奉市场地位。
2003年新型的自由基清除型脑保护剂依达拉奉由先声药业率先研发成功,商品名必存,适用于改善急性脑梗塞所致的神经症状、日常生活活动能力和功能障碍。迄今为止,CFDA颁发了16家企业原料和12家企业注射剂生产批文。
据米内网数据显示,2017年国内16个重点城市400家公立医院依达拉奉用药金额6.72亿元,同比上一年略有下滑,在“限抗限输液”的形势下,仅下滑1.85%。国内公立医疗机构是依达拉奉的主要消费终端,2016年用药总额为54.31亿元,2017年用药总额为60亿元,同比增长了2.28%。国内ALS临床获得持续进展,将推动市场增长。
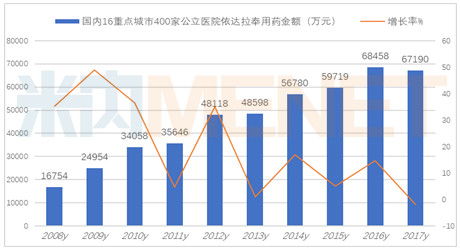
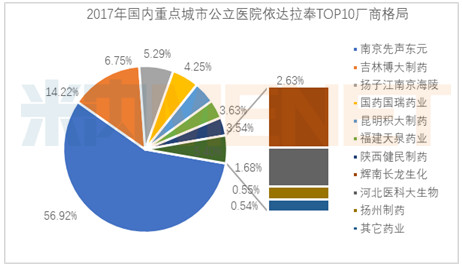
依达拉奉市场2017年TOP10品牌见文中图表,其中排名前5的南京先声的“必存”占据56.92%,吉林博大的“易达生”占据14.22%,扬子江南京海陵的“依风”占据6.75%,国药国瑞的“依达”占据了5.29%,昆明积大的“积华尤敏”占据了4.25%,其它进入医院市场的七家占据了12.57%的份额。
利鲁唑2017年增长率高达70%
利鲁唑是赛诺菲安万特公司开发的药物,1996年美国FDA批准上市,商品名为Rilutek。1999年赛诺菲安万特公司的利鲁唑片剂在中国上市,商品名“力如太”。利鲁唑是是第一个获美国FDA和欧盟批准用于治疗ALS的药物。也是目前唯一公认对缓解ALS进展有效的药物,可改善病人生存状态,却无法阻止ALS病情的发展。
利鲁唑通过抑制脑内神经递质(谷氨酸及天冬氨酸)的释放,抑制兴奋性氨基酸的活性及稳定电压依赖性钠通道的失活状态来表现其神经保护作用。研究证明利鲁唑可减少兴奋性递质的毒性作用,增加细胞的存活率来达到治疗的目的。目前,利鲁唑片剂是国内渐冻人症临床上主要药物。 国产利鲁唑由鲁南贝特、江苏恩华、万特(海南)等三家生产,从而构成了进口与国产四家垄断市场的格局。
据米内网数据显示,2017年国内16个重点城市400家公立医院利鲁唑口服制剂用药金额为1558万元,同比上一年增长了70.32%。其中赛诺菲安万特公司的“力如太”片剂占据了81.66%,鲁南贝特公司的胶囊剂“协一力”占据了13.88%,江苏恩华公司的利鲁唑片占据了4.96%,万特(海南)的“万全力太”所占份额较少。
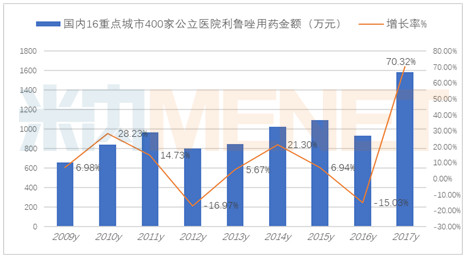
三家均呈现出高增长的态势,赛诺菲安万特公司的“力如太”片剂增长率为71.47%,鲁南贝特公司的胶囊剂“协一力”增长率为43.37%,江苏恩华公司的利鲁唑片增长率高达182.42%。
国内渐冻人症辅助用药
在我国临床用药方面,鼠神经生长因子、单唾液酸四己糖神经节苷脂钠是“渐冻人症”辅助治疗药品。近两年,受适应症限制、重点监控目录等医改控费指标影响,市场增幅下滑。另一方面在公司不断优化产品策划和学术推广水平,提高品牌和产品的知名度、治疗地位下,仍是神经领域中领军品种。
鼠神经生长因子四家垄断
鼠神经生长因子是国家Ⅰ类生物制品。迄今为止,我国已批准舒泰神(北京)生物制药股份、厦门未名生物医药、武汉海特生物制药股份、丽珠集团丽珠制药厂等4家生产注射用鼠神经生长因子。
鼠神经生长因子对脑血管疾病,以及头颅、脊髓损伤、神经变性性疾病和神经系统发育障碍有较好疗效;对促进神经再生修复、增强内源性神经营养活性的作用更突出,也是用于渐冻人的治疗药物。
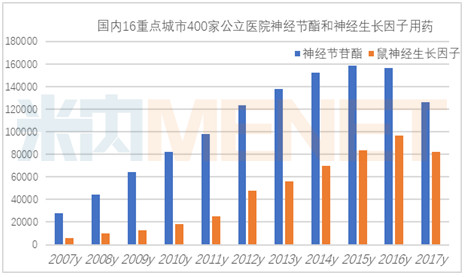
据米内网数据显示,2017年国内16个重点城市400家公立医院鼠神经生长因子用药为8.18亿元,同比上一年负增长15.53%,在医院控药的趋势下,市场起伏跌宕。
神经节苷脂钠百亿终端
单唾液酸四己糖神经节苷脂钠(简称神经节苷酯,GM-1)用于中枢神经系统创伤性或血管性病变,如脑损伤、脊髓损伤、缺血性及出血性脑血管意外和帕金森氏病的治疗,是用于渐冻人的治疗药物之一。
20世纪80年代,神经节苷酯首先在意大利上市, 1984年我国参与了WHO组织的“复合型神经节苷酯治疗周围神经病变”临床研究。1996年这一药物已进入我国临床使用,我国先后批准进口了阿根廷TRB Pharma S.A.公司和巴西TRB Pharma Ind Quimica E Farmaceutica Ltda公司的神经节苷酯钠,以商品名“施捷因”和“重塑杰”上市。2004年11月,齐鲁制药开发的神经节苷酯率先获得注册生产,目前已批准7家制剂上市。国产神经节苷酯上市后,改善了神经系统药物市场的产品结构,替代了进口药物,加快了产品的增长速度。
